
发布者: 蓝丽旌 发布时间: 2024-09-05 浏览次数: 17
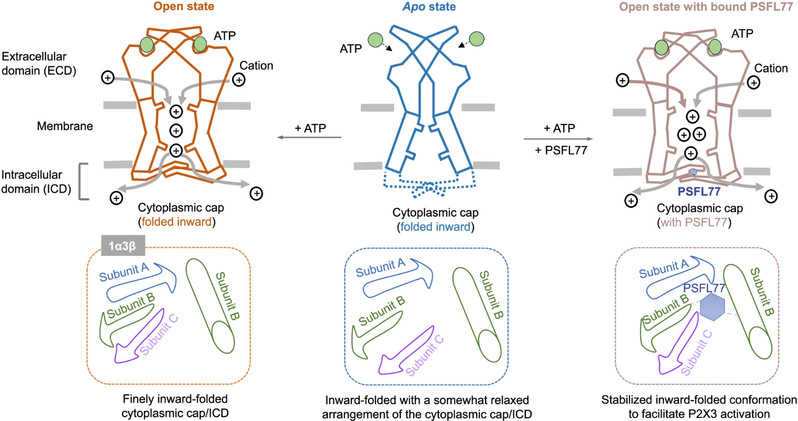
近日,我校王恒山教授与中国药科大学于烨教授、汪津教授团队合作在国际知名期刊Nature Communications《自然·通讯》上在线发表了题为“Finely ordered intracellular domain harbors an allosteric site to modulate physiopathological function of P2X3 receptors”的研究论文,该研究提出P2X3受体的ICD具有类似于开放状态的载脂蛋白状态构象,但具有不那么紧张的结构,包含影响P2X3生理和病理作用的变构位点。
团队通过共价占有、工程二硫键和电压钳荧光测定,发现ICD可以与P2X3的跨膜结构域进行协调运动,从而促进通道激活。研究还发现了新的P2X3受体增强子PSFL77,它作用于P2X3的ICD。利用PSFL77作为化学工具,结合工程二硫键和荧光非天然氨基酸(flUAA)发射光谱的变化,研究发现P2X3受体的ICD在载脂蛋白状态下采用了一个组装良好的开放状态,但略有不同的构象。
原文链接:https://www.nature.com/articles/s41467-024-51815-7